Cláudio M. Gomes
O mestrado em Bioquímica de Ciências visa proporcionar formação avançada em tópicos da Bioquímica com impacto na compreensão de processos moleculares, bioquímicos e celulares relevantes em problemas de vanguarda da Biologia e em Biomedicina, através da especialização em Bioquímica Médica. No site do curso encontra as saídas profissionais, a estrutura curricular e vários testemunhos. A primeira fase de candidaturas deste e de outros mestrados em Ciências termina a 11 de julho.
A ciência é global e colaborativa. Quem o diz é Cláudio M. Gomes, professor do Departamento de Química e Bioquímica e coordenador do FCUL Protein Folding and Misfolding Laboratory (FPFML) do Instituto de Biossistemas e Ciências Integrativas (BioISI). Recentemente, juntamente com outros cientistas descobriu um novo mecanismo bioquímico nas células nervosas, que retarda a formação dos depósitos de agregados de proteína no cérebro, causadores da doença de Alzheimer. Na entrevista que se segue fica a conhecer os próximos passos desta investigação.
Começou a dar aulas em Ciências em 2015. Quais são as disciplinas que leciona e como está a correr esse trabalho?
Cláudio M. Gomes (CG) - Lecionar em Ciências está a ser um prazer, um desafio constante e uma oportunidade para verter na docência os saberes da investigação científica. No mestrado em Bioquímica leciono Estrutura e Função de Proteínas e Projeto Experimental I e II, disciplinas obrigatórias em que abordo conceitos e métodos relacionados com a minha área de especialização, a Bioquímica Estrutural e folding de proteínas. No ano letivo passado, lancei uma nova disciplina opcional, a Bioquímica da Neurodegeneração, que enquadra conteúdos com muita atualidade na intersecção da Bioquímica com a Biomedicina, e que teve uma excelente aceitação por parte dos alunos. Na licenciatura em Bioquímica coordeno a Bioquímica Experimental II, disciplina do 2.º ano focada no treino laboratorial, e já no próximo ano letivo terei um novo desafio: a docência de Bioquímica I, aos alunos do 1.º ano, no que constitui o seu primeiro contacto com uma disciplina de Bioquímica e onde ensinarei os fundamentos sobre proteínas e sua estrutura. Desde março sou também o coordenador do mestrado em Bioquímica, que estamos empenhados em dinamizar.
A investigação feita no FCUL Protein Folding and Misfolding Laboratory do BioISI é de cariz fundamental em Bioquímica Estrutural, com fortes implicações em Biomedicina. O grupo, coordenado por Cláudio M. Gomes, usa como modelos de estudo proteínas envolvidas em doenças como o Alzheimer, ELA e erros inatos do metabolismo mitocondrial. Atualmente, o grupo é composto por oito elementos: um investigador doutorado, três doutorandos, dois bolseiros investigação e dois alunos de mestrado.
Coordena o laboratório FPFML do BioISI desde quando?
CMG - Coordeno este laboratório desde 2003, mas com a minha vinda para Ciências em 2015 e integração no BioISI e no Departamento de Química e Bioquímica de Ciências, o laboratório também se mudou - equipamentos e investigadores – para instalações laboratoriais próprias no C8, onde estamos desde essa data.
Qual o balanço que faz da atividade deste grupo de investigação?
CMG - Faço um balanço muito positivo. Em Ciências o laboratório deu continuidade à sua missão – Investigar e relacionar alterações na estrutura e folding de proteínas com processos fisiopatológicos em neurodegeneração e doenças metabólicas raras, as chamadas doenças do folding proteico. (…) Nos últimos anos, e também através de novas oportunidades no contexto do BioISI, o laboratório estabeleceu novas colaborações e consolidou a sua reputação com novas publicações, participação em projetos internacionais e treino de jovens investigadores. Este é aliás um aspeto que considero muito importante e cujo balanço desde que estamos em Ciências é muito favorável.
O grupo tem beneficiado da visibilidade de Ciências para alunos de mestrado e ERASMUS+ realizarem temas de investigação no laboratório, assim como das oportunidades de formação avançada através do programa doutoral BioSYS e do programa pós-doutoral do BioISI. Em breve teremos a defesa das primeiras teses de doutoramento made in Ciências. (…)

Fonte JV
No que diz respeito ao estudo publicado no final de junho na Science Advances, descobriram um novo mecanismo bioquímico nas células nervosas que retarda a formação dos depósitos de agregados de proteína no cérebro, causadores da doença de Alzheimer. Como é que esta descoberta aconteceu?
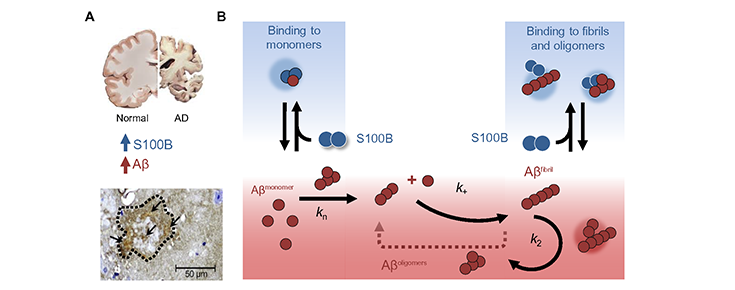
CMG - O nosso trabalho anterior havia mostrado que a S100B, uma proteína de alarme produzida quando ocorre neurodegeneração, possui segmentos que favorecem a agregação que são expostos aquando da ligação de cálcio. De igual forma, sabe-se que a proteína S100B se acumula em elevadas quantidades junto das placas [depósitos] de amiloide nos cérebros com Alzheimer, ricos na proteína beta-amiloide agregada. A descoberta agora publicada resulta assim da pergunta: será que a acumulação da proteína S100B poderá ter um efeito sobre a formação de agregados de beta-amiloide. De facto, o que o estudo mostra é que esta “coincidência” tem razão de ser, dado que descobrimos que a proteína S100B interage com a proteína beta-amiloide, atrasando a sua agregação, revertendo mesmo a toxicidade induzida por estes agregados, o que reforça este seu novo papel na defesa anti agregação.
Quais são as implicações desta descoberta?
CMG - A nova função que agora evidenciamos para a proteína S100B como regulador da agregação proteica no contexto de Alzheimer, estabelece um novo elo entre dois processos celulares que estão profundamente afetados em várias doenças neurodegenerativas: agregação proteica e neuroinflamação. Esta investigação desvenda novas funções das alarminas S100 que poderão ser até comuns entre patologias neurodegenerativas para além da doença de Alzheimer. Assim, abrem-se perspetivas sobre a possibilidade do conhecimento agora gerado poder vir a contribuir para o desenvolvimento futuro de terapias direcionadas para estes alvos.
Vão continuar a colaborar? Isto é, quais são os próximos passos desta equipa?
CMG - Vamos continuar a explorar as funções das proteínas S100B em neurodegeneração, agora recorrendo a ensaios com modelos animais. Estamos a testar uma biblioteca de anticorpos anti-S100 por forma a verificar se conseguimos amplificar o efeito antiagregação que agora demonstramos. O trabalho agora publicado ilustra a realidade da investigação científica atual: global e colaborativa. Assim, apesar destas investigações terem a sua génese no meu laboratório em Ciências, vamos continuar a colaborar com estes e outros membros da nossa rede colaborativa, nacional e internacional.
Fonte AAAS