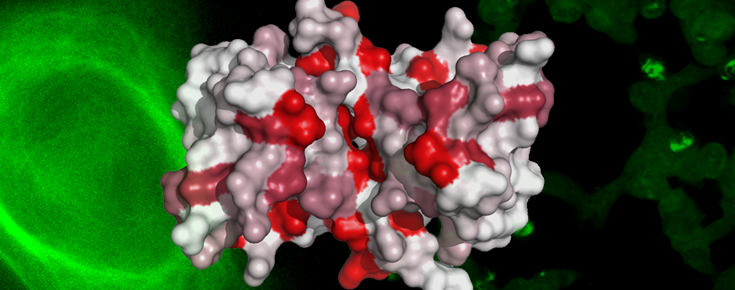
Estrutura 3D da proteína S100B (ler nota da redação en baixo)
Scripta manent. O que se escreve, fica, permanece.
Leia os artigos publicados no Observador, Lusa, TSF , Diário de Notícias, Jornal de Notícias, JM Madeira, Delas, Correio da Manhã ( URL1 e URL2), Canal Alentejo, Cidade FM, Health News, O Minho, On Centro, Rádio Comercial, Diário da Saúde, dnoticias.pt, Impala, Notícias de Coimbra, Penacova Actual, Postal, TVI (entre os 49:29 e 51:47) sobre este tema.

Fonte ACI Ciências ULisboa
Uma equipa internacional liderada pelo cientista Cláudio M. Gomes, professor do Departamento de Química e Bioquímica na Ciências ULisboa e coordenador do laboratório Protein Misfolding and Amyloids in Biomedicine (PMAB), afiliado ao Instituto de Biossistemas e Ciências Integrativas (BioISI), descobriu uma nova função para uma proteína do cérebro, que atrasa a formação de depósitos proteicos causadores de demências como a doença de Alzheimer.
A descoberta, publicada esta segunda-feira na revista científica Nature Communications, e anunciada pela Faculdade em comunicado de imprensa, revela que a proteína S100B atua sobre a proteína Tau, cuja deposição tóxica no cérebro está associada a várias demências e à fase de agravamento da doença de Alzheimer.
“A proteína Tau atua na estabilização dos microtúbulos, as estruturas que mantêm a arquitetura dos neurónios. Contudo, através de uma reação de autoassociação [agregação] anormal, esta proteína adota facilmente uma forma aberrante que leva à sua acumulação nos tecidos. É o que sucede na doença de Alzheimer, em que alterações bioquímicas promovem a libertação da proteína Tau dos microtúbulos, o que desencadeia a sua agregação”, elucida Cláudio M. Gomes, coordenador do estudo. “Estes depósitos de proteína Tau são tóxicos e matam os neurónios, sendo também libertados para o exterior das células, disseminando a patologia às células vizinhas”, explica ainda o cientista.
Na sequência de um estudo anterior desta equipa, sabia-se que a proteína S100B desempenha no cérebro algumas funções protetoras, e que os seus níveis aumentam com o envelhecimento, um conhecido fator de risco para demências. A descoberta agora publicada mostra que a proteína S100B interage com a proteína Tau nos microtúbulos, dentro das células e que mesmo quando perturbados os microtúbulos com libertação da forma tóxica da proteína Tau, essa interação persiste. Esta observação levou a equipa a estudar como interagem as duas proteínas, e a determinar as respetivas consequências biológicas.
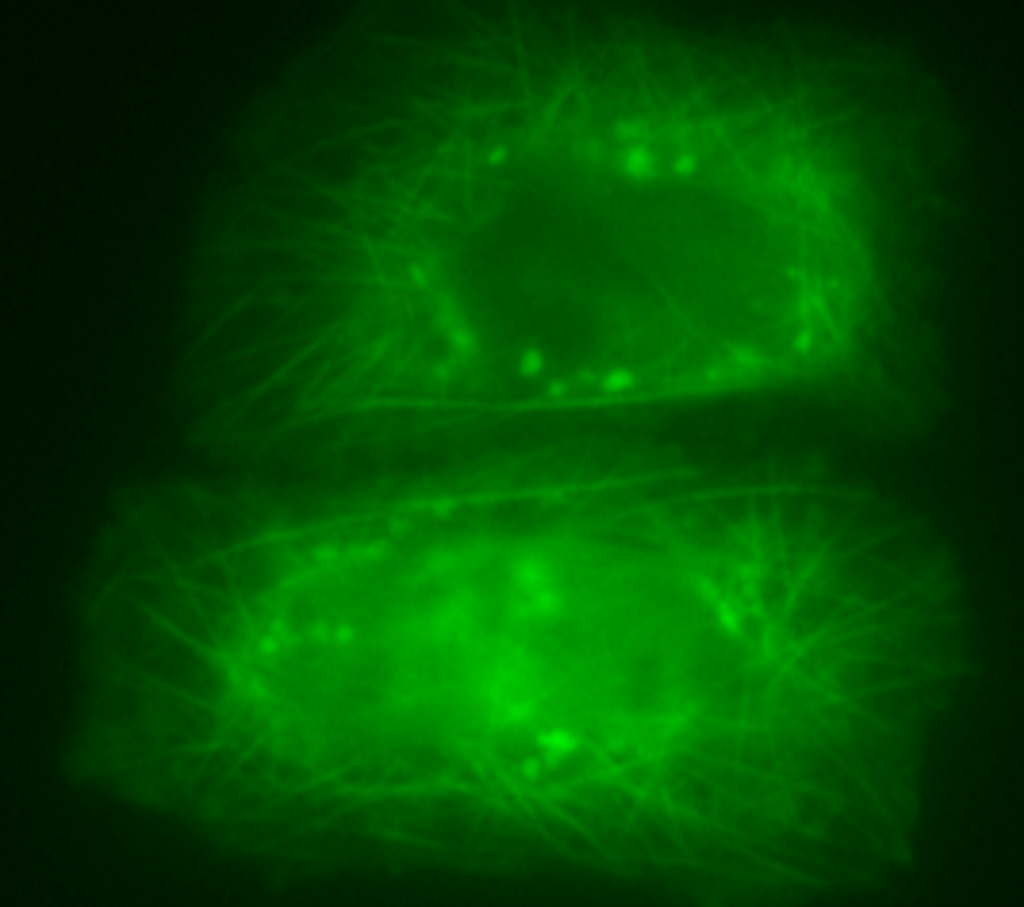
Fonte Autores/Nature Communications
“Investigamos a formação de agregados da proteína Tau ao longo do tempo, e observamos que a mesma é atrasada na presença da proteína S100B”, conta Guilherme Moreira, estudante de doutoramento em Bioquímica na Ciências ULisboa, orientado por Cláudio M. Gomes, e primeiro autor do estudo. “Claramente havia um efeito inibitório resultante da associação entre as duas proteínas, que descobrimos ser muito dinâmica e ocorrer sobretudo entre a região da proteína Tau responsável pela agregação e uma concavidade na proteína S100B, que sabíamos ter um papel regulatório nestes processos”, explica o jovem investigador, que concluiu a licenciatura e o mestrado em Bioquímica nesta faculdade. O estudo também revelou que a proteína S100B evita que formas tóxicas da proteína Tau libertadas para o exterior das células corrompam as células vizinhas. Para Cláudio M. Gomes, “este aspeto é muito relevante dado que a proteína S100B é também excretada pelos astrócitos [tipo de célula do sistema nervoso central], pelo que esta descoberta revela uma ampla atividade protetora desta proteína, que atua dentro e fora das células”.
Esta investigação foi desenvolvida em colaboração com investigadores da Universidade de Lille (França), I3S - Instituto de Investigação e Inovação em Saúde (Portugal), Universidade de Hohenheim (Alemanha) e da University of Texas Medical Branch (EUA). Da parte da Ciências Lisboa e do BioISI, para além de Guilherme Moreira e de Cláudio M. Gomes, também participaram no estudo a aluna de doutoramento em Bioquímica Joana Cristóvão; as investigadoras doutoradas Andrea Quezada, Filipa Carvalho e Ana Carapeto; e os professores Mário Rodrigues e Federico Herrera.
Segundo os investigadores, este resultado é muito relevante no contexto da doença de Alzheimer, dado que o aparecimento de sintomas cognitivos e demência estão associados aos danos causados pelos agregados da proteína Tau, e à disseminação da patologia para múltiplas regiões do cérebro. “Este estudo desvenda um novo mecanismo biológico de proteção, relevante nas fases iniciais da doença, que se torna ineficiente ao longo do tempo com o crescente acumular de agregados tóxicos no cérebro”, conclui o coordenador desta investigação.
As demências neurodegenerativas associadas à formação de agregados da proteína Tau, como a doença de Alzheimer, afetam milhões de pessoas em todo o mundo. A expectativa resultante deste trabalho de investigação fundamental é de que a compreensão do funcionamento de moléculas protetoras como a S100B possa inspirar o desenvolvimento de fármacos, com potencial terapêutico, que possam atuar de forma semelhante.
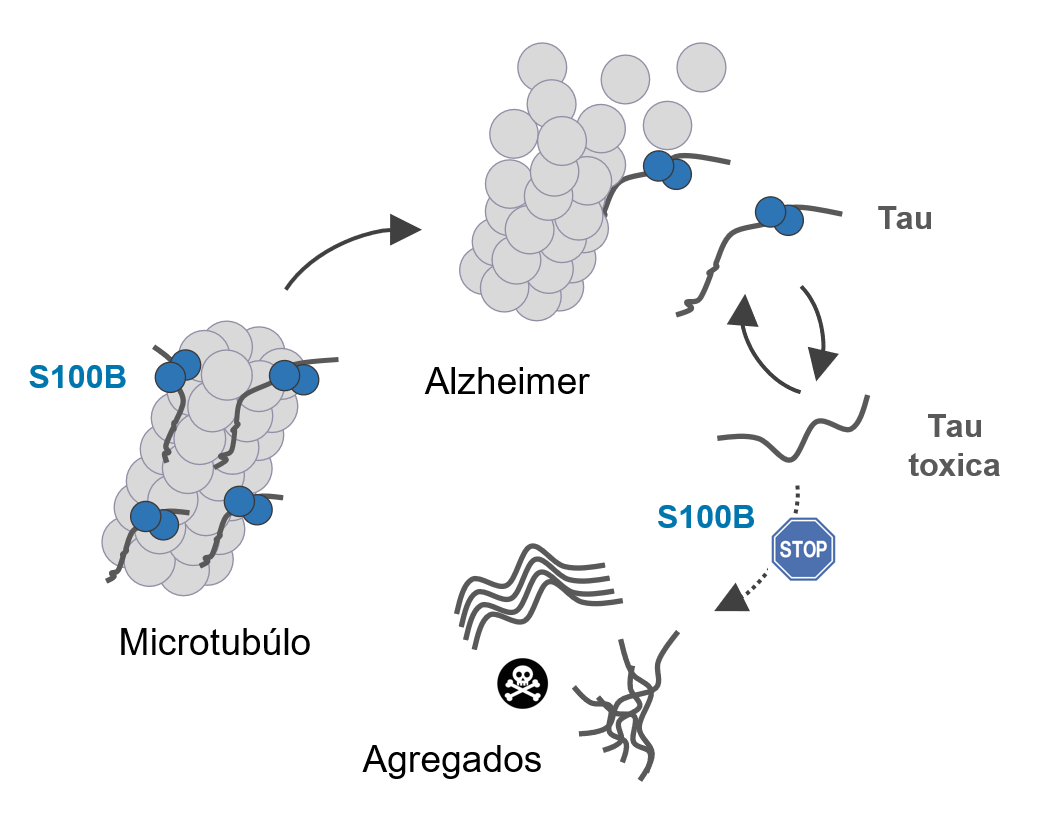
Fonte CMG
Nota da redação
Legenda da imagem principal: Plano central anterior - Estrutura 3D da proteína S100B colorida a vermelho de acordo com as zonas preferenciais de ligação à proteína Tau; Plano posterior (esquerda) - célula marcada a verde indicando colocalização das proteínas S100B e Tau nos microtúbulos; Plano posterior (direita) - depósitos de proteína Tau agregada em células, identificados como manchas verdes
Cláudio M. Gomes dedica esta obra à memória da sua amiga e mentora - a professora Maria de Sousa (1939–2020) - "por sempre nos fazer crer que podemos ver o não visto".