![Um novo composto de crípton Complexo não covalente de composição [KrSF5]+ (Fig. 1), que provem duma molécula estável, [KrSF6]+ (Fig. 2), em resultado da reação direta de hexafluoreto de enxofre com crípton ionizado](https://ciencias.ulisboa.pt/sites/default/files/styles/destaque/public/1319.png?itok=ym4W9Hma)
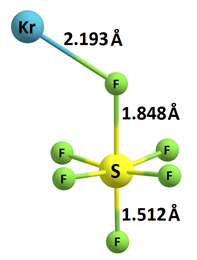
Complexo não covalente de composição [KrSF5]+ (Fig. 1), que provem duma molécula estável, [KrSF6]+ (Fig. 2), em resultado da reação direta de hexafluoreto de enxofre com crípton ionizado
Os gases nobres são elementos que possuem a sua camada exterior de eletrões completa e que se situam na coluna mais à direita da Tabela Periódica. Este grupo 18 é constituído por hélio, néon, árgon, crípton, xénon, rádon e oganésson. Os gases nobres estão presentes no ar que respiramos, no entanto, a sua presença manteve-se desconhecida até ao final do século XIX. Mesmo depois de conhecidos e isolados, acreditava-se que, devido a terem a camada exterior de eletrões completa, a sua capacidade de formar compostos com outros elementos era reduzida ou mesmo nula. Em 1962, Neil Bartlett reportou a síntese, pela primeira vez, de um composto contendo xénon [1]. Estamos agora a comemorar os 60 anos desse grande marco da Química e esta história está apresentada de maneira sucinta, mas muito apelativa, num artigo publicado por Felice Grandinetti no número de 6 de junho de 2022 da revista Nature [2].
Os gases nobres têm imensas aplicações: o hélio é usado em balões e dirigíveis, em garrafas para mergulho a grande profundidade e em criogenia; o néon é usado em válvulas estabilizadoras de tensão e anúncios luminosos; o árgon é utilizado para se obter atmosferas inertes que permitem fundir determinados materiais e soldar metais; o xénon é usado na iluminação pública e na produção de flashes eletrónicos; e alguns deles, hélio néon e árgon, são usados em lasers.
Apesar dos muitos avanços verificados nestes 60 anos, ainda existe muito a descobrir sobre a química dos gases nobres. Têm existido importantes desenvolvimentos recentes e, por exemplo, talvez seja possível gerar num futuro próximo novas estruturas estáveis de gases nobres recorrendo a eletrófilos aniónicos [3].
A nossa equipa, que envolve investigadores do Centro de Química Estrutural (IST e Ciências ULisboa) e do BioISI, estuda a reatividade de gases nobres na fase gasosa, tentando entender quais os fatores que são importantes na química destes elementos.
Esses estudos são feitos experimentalmente recorrendo a espectrometria de massa de ressonância ciclotrónica de iões com transformada de Fourier [4] e também recorrendo a cálculos computacionais usando modelos teóricos avançados.
Fonte Figura cedida por NB
Num estudo publicado a 27 de maio deste ano, a equipa provou experimentalmente a existência de um complexo não covalente de composição [KrSF5]+ (Fig. 1), que provem duma molécula estável, [KrSF6]+ (Fig. 2), em resultado da reação direta de hexafluoreto de enxofre com crípton ionizado [5].
Sem entrar em pormenores demasiado técnicos, podemos dizer que se mostrou que o crípton ionizado reage com uma molécula neutra de SF6 dando origem a um composto até agora desconhecido.
Os cálculos computacionais permitiram uma interpretação da estabilidade da nova espécie e da sua precursora, aumentando o nosso conhecimento e capacidade de previsão da química dos gases nobres.
O grupo dos gases nobres é conhecido por demonstrar pouca reatividade. Juntamente com os cientistas Sandrina Oliveira, Joaquim Marçalo, João Paulo Leal, Leonor Maria, José Carretas, Bernardo Monteiro provámos experimentalmente, por intermédio da técnica espectrometria de massa, a existência dum complexo não covalente de composição [KrSF5]+ e cuja proveniência advém da molécula estável [KrSF6]+, representada na figura 3, resultado da reação direta do hexafluoreto de enxofre (SF6) com o crípton ionizado (Kr+). Estes resultados aumentam o nosso conhecimento da química dos gases nobres uma área ainda pouco explorada da Química Inorgânica e com enorme potencial para se expandir.
Referências
[1] Bartlett, N.; Xenon Hexafluoroplatinate(V) Xe+[PtF6]-; Proceedings of the Chemical Society, 1962, 218. DOI: 10.1039/PS9620000197
[2] Grandinetti, F.; 60 Years of Chemistry of the Noble Gases; Nature, 06 June 2022. DOI: 10.1038/d41586-022-01534-0
[3] Rohdenburg, M.; Azov, V. A.; Warneke, J.; New Perspectives in the Noble Gas Chemistry Opened by Electrophilic Anions; Frontiers in Chemistry, 2020, 8, 580295. DOI: 10.3389/fchem.2020.580295
[4] Marçalo, J.; A Espectrometria de Massa de Ressonância Ciclotrónica de Iões com Transformada de Fourier; Química - Boletim da Sociedade Portuguesa de Química, 1997, 66, 32-41. DOI: 10.52590/M3.P590.A3000807
[5] Oliveira, S.; Bandeira, N. A. G.; Leal, J. P.; Maria, L.; Carretas, J. M.; Monteiro, B.; Marçalo, J.; A New Krypton Complex – Experimental and Computational Investigation of the Krypton Sulphur Pentafluoride Cation, [KrSF5]+, in the Gas Phase; Physical Chemistry Chemical Physics, 2022, 24, 14631 -14639. DOI: 10.1039/D1CP05814B


