Jacques Dubochet, Joachim Frank e Richard Henderson
O Prémio Nobel da Química foi atribuído em 2017, em partes iguais, a três investigadores, Jacques Dubochet (Universidade de Lausana, Suiça), Joachim Frank (Universidade de Columbia, Nova Iorque, EUA) e Richard Henderson (Laboratório MRC de Biologia Molecular, Cambridge, UK) pelo desenvolvimento da microscopia crioelectrónica que permite a resolução da estrutura de biomoléculas em solução com alta resolução.
O grande avanço na determinação de estruturas de sistemas moleculares foi a cristalografia de raios-X, que durante o século XX permitiu a determinação da estrutura, com resolução atómica, para moléculas pequenas e, com elevada resolução (2-3 Å,) para as biomoléculas, como as proteínas. Contudo, esta técnica exige a utilização de cristais. Muitas biomoléculas não cristalizam facilmente e outras decompõem-se durante o processo.
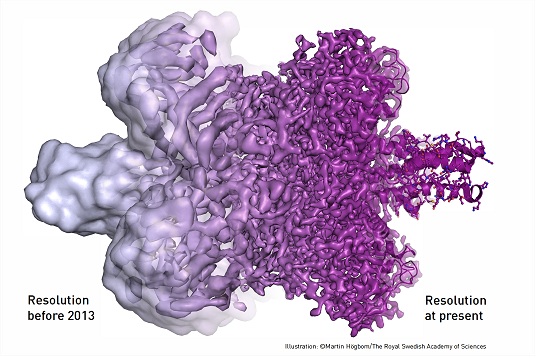
Henderson teve a ideia de usar microscopia eletrónica de transmissão (TEM – transmission electron microscopy) para determinar as suas estruturas. Esta técnica permitia obter, com os equipamentos de alta resolução, certas estruturas moleculares, bidimensionais, com detalhe atómico, mas as biomoléculas geralmente perdiam a estrutura e decompunham-se nas condições operacionais (feixe de eletrões de alta energia e vácuo).
Os melhoramentos que permitiram resolver o problema envolveram dois aspetos. Um deles consistiu na análise e no tratamento dos dados experimentais, por meios matemáticos e computacionais, de modo a obter imagens bem definidas que pudessem mostrar o detalhe das estruturas. Foi este o campo de intervenção de Joachim Frank. O outro permitiu encontrar condições em que as biomoléculas mantivessem a sua identidade – forma e estrutura. Jacques Dubochet estudou meios de as proteger para evitar, por exemplo, a desidratação que levava ao seu colapso. A forma que veio a provar ser mais eficaz foi envolver as biomoléculas em estudo num filme fino de água e forçar a congelação de água na forma de vidro (amorfo) evitando a sua cristalização. Nada disto foi fácil e envolveu anos de trabalho das várias equipas até chegar à microscopia crioelectrónica.
Qual a vantagem de conhecer detalhadamente as estruturas das moléculas, em particular das biomoléculas que são grandes e complexas? Para além da sua beleza, o conhecimento das estruturas permite a conceção de fármacos destinados a alvos bem definidos, tornando essa conceção mais racional e menos aleatória.